 |
|
ინსულტის შემდგომი ცენტრალური ტკივილის სინდრომი ზურაბ ნადარეიშვილი ჯანმრთელობის ნაციონალური ინსტიტუტის ინსულტის პროგრამა, სუბურბან ჰოსპიტალი, ჯონს ჰოპკინსის სამედიცინო სისტემა, ბეთესდა, მერილენდი, აშშ
ინსულტის შემდგომი ტკივილი თავის ტვინში სისხლის მიმოქცევის მოშლის ერთ-ერთი არცთუ ისე იშვიათი გართულებაა. ამ სახელწოდებაში გაერთიანებულია ინსულტის შემდგომი არა მარტო ნეიროპათიური, არამედ ძვალ-კუნთოვანი და სისხლძარღვოვანი სისტემების დაზიანებით გამოწვეული ტკივილის სინდრომები. ინსულტის შემდგომი ტკივილის სინდრომები ნეიროპათიური კომპლექსური რეგიონული ცენტრალური პერიფერიული ძვალ-კუნთოვანი ჰემიპლეგიის შემდგომი მხრის სპასტიური სისხლძარღვოვანი ღრმა ვენების თრომბოზი არტერიული განშრევება და სხვ. ამ მიმოხილვის მიზანს წარმოადგენს ინსულტის შემდგომი ტივილის ერთ-ერთი ყველაზე უფრო გავრცელებული ტიპის – ცენტრალური ტკივილის სინდრომის გაშუქება თანამედროვე სამედიცინო ლიტერატურაში მოპოვებული ინფორმაციის საფუძველზე. ინსულტის შემდგომი ცენტრალური ტკივილი – Central Poststroke Pain - CPSP ეწოდება ინსულტის შედეგად განვითარებულ მუდმივ ან ხანგამოშვებით ტკივილს, რომელიც გავრცელებულია სხეულის იმ ნაწილში, სადაც აღინიშნება ინსულტით გამოწვეული მგძნობელობის მოშლა. CPSP-ის მატერიალურ სუბსტრატს წარმოადგენს მგრძნობელობის ცენტრალურ სისტემაში ინსულტის შედეგად წარმოქმნილი დაზიანების კერა, რომელიც იწვევს მიღებული ინფორმაციის არასწორად გადამუშავებას და შესაბამისად, სენსორული ქსელის ფუნქციის დარღვევას.
CPSP-ის პირველი შემთხვევების აღწერა XIX საუკუნის 80-იანი წლებიდან იწყება. ამ სინდრომთან დაკავშირებული ადრეული პუბლიკაციები ეკუთვნით მეცნიერებს: Greitt (1883), Wallenberg (1895), Edinger (1897) და Weir Mitchell (1897). საინტერესოა აღინიშნოს, რომ 1895 წელს ცნობილი გერმანელი ნევროლოგი ვალენბერგი აღწერს მოგრძო ტვინის ლატერალური ინფარქტის კლასიკურ სიდრომს 38 წლის მამაკაცის შემთხვევის მაგალითზე , რომელიც “უჩიოდა თავბრუსხვევას გონების დაკარგვის გარეშე, ჰიპერესთეზიას ტკივილით სახის მარცხენა და სხეულის მარჯვენა ნახევარში”. [1] 1906 წელს, ცნობილმა ფრანგმა ნევროლოგმა Dejerin-მა და პათანატომმა Roussy-მ პირველად აღწერეს თალამუსის ინფარქტის შედეგად განვითარებული აუტანელი, ძლიერი ტკივილის სინდრომი. ეს სინდრომი დაზიანების კერის მოპირდაპირე მხარეს ტკივილის გარდა ხასიათდებოდა ჰეიპლეგიით, ჰემიანესთეზიით, ჰემიატაქსიით და ქორეოათეტოზიით. ავტორებმა ასევე აღწერეს ამ სინდრომის პათოლოგანატომიური სუბსტრატი, ინფარქტის არსებობის სახით, თალამუსში. 1969 წელს, Cassarini და Pagni-მ დაასაბუთეს, რომ CPSP შესაძლებელია განვითარდეს არა მარტო თალამუსის, არამედ სპინო-თალამური და თალამო-კორტიკული გზების დაზიანების ნებისმიერ დონეზე. [2] 
CPSP-ის პათოფიზიოლოგია საბოლოოდ დადგენილი არ არის. როგორც შესავალში აღვნიშნეთ, სპინო-თალამო-კორტიკული გზის დაზიანება CPSP-ის აუცილებელი პირობაა. CPSP-ის პათოფიზიოლოგიური თეორიებია: [3] ცენტრალური დისინჰიბიცია დაქვეითებული GABA-ერგული ინჰიბიცია ცენტრალური აგზნება სპონტანური აქტივობა ლატერალურ და მედიალურ თალამუსის ბირთვებში თერმოსენსორული ინჰიბიცია უკანა დორზალური ინსულური ქერქის დაღმავალი ინჰიბიციის კონტროლის დაკარგვა დარღვეული ცენტრალური მოდულაცია სპინო-თალამო-კორტიკული გზის ლამინარულ შრეში ცენტრალური ტემპერატურული ბოჭკოების განლევა ამინერგული მოდულაციის დაკარგვა ადრენერგული მოდულაციის დაქვეითება სეროტონინერგული მოდულაციის დაქვეითება NMDA-გლუტამინერგული სისტემის ფუნქციის დარღვევა გაძლიერებული თალამო-კორტიკული გლუტამინერგული სტიმულაცია. შესაძლებელია , რომ რამდენიმე ზემოთ ჩამოთვლილი მექანიზმი ერთდროულად მოქმედებდეს, რაც კიდევ უფრო ართულებს არა მარტო CPSP-ის ეტიოლოგიის დადგენას, არამედ მკურნალობასაც.
ცენტრალური ნეიროპათიული ტკივილის სინდრომის განვითარება მეტად დამახასიათებელია გაფანტული სკლეროზისა და ზურგის ტვინის დაზიანებისათვის. მიუხედავად ამისა, CPSP უფრო ხშირად გვხვდება სამედიცინო პრაქტიკაში, რადგან თავად ინსულტის გავრცელება (პრევალენტობა) ბევრად უფრო მაღალია, ვიდრე ზემოთ აღნიშნული ავადმყოფობებისა. როგორც შესავალში აღვნიშნეთ, ინსულტის შემდგომი ტკივილი სხვადასხვა სინდომებს მოიცავს. ერთ-ერთი უახლესი გამოკვლევის მიხედვით, იშემიური ინსულტის შემდეგ ავადმყოფთა 10.6%-ს აღენიშნებოდა რომელიმე ტიპის ტკივილი. [4] ამ ტკივილებიდან ყველაზე უფრო ხშირი იყო CPSP, რომელიც დარეგისტრირდა შემთხვევათა 2.7%-ში. პერიფერული ნეიროპათიური ტკივილი დადასტურდა ავადმყოფთა 1.5%- ში, სპასტიური 1.3%-ში, ხოლო მხრის ქვეამოვარდნილობით გამოწვეული ტკივილი აღიწერა შემთხვევათა მხოლოდ 0.9%-ში. ეს ლიტერატურაში არსებული ერთ-ერთი ყველაზე უფრო დიდი (n=15 754 ავადმყოფი) გამოკვლევაა და PRoFESS კვლევის მეორად ანალიზს წარმოადგენს. [5] საინტერესოა აღინიშნოს, რომ CPSP-ის განვითარების სტატისტიკურად სარწმუნო წინამორბედი ფაქტორები იყო: ახალგაზრდა ასაკი დეპრესია თამბაქოს მოხმარება ინსულტის სიმძიმე. ამ გამოკვლევიდან გამომდინარე, CPSP ინსულტის შემდგომი ტკივილის ყველაზე უფრო ხშირი სინდრომია. მაგრამ აქვე უნდა აღინიშნოს, რომ PRoFESS-ში ჩართულები არ იყვნენ მძიმე ფორმის მქონე ავადმყოფები და 85%-ს NIH-ინსულტის სკალა 5-ზე ნაკლები ჰქონდა. [6] ალბათ ამის გამო აღირიცხა ინსულტის შემდგომი ტკივილის შედარებით დაბალი მაჩვენებელი (10.6%), მაშინ როდესაც სხვა ნაშრომებში გავრცელება 14-დან 34%-მდე მერყეობდა.[7] CPSP-ით ავადობა იშემიური ინსულტის შემდეგ 8%-ია, ხოლო თალამური ჰემორაგიის შემდეგ – 9%.[8] შემთხვევათა დაახლოებით 63%-ში, CPSP ვითარდება ინსულტის განვითარების შემდეგ პირველ თვეში.[9] თალამუსის დაზიანება CPSP-ის ერთ-ერთ ყველაზე უფრო ხშირ მიზეზს წარმოადგენს (33%).[10]
CPSP-ის ტიპური კლინიკური სურათი წარმოდგენილია ძლიერი ტკივილით ინსულტით დაზიანებული კერის მოპირდაპირე მხარეს და ასოცირებულია მგრძნობელობის მოშლასთან ამავე მიდამოში. CPSP შეიძლება იყოს სპონტანური ან გამოწვეული. სპონტანური ტკივილი კი თავის მხრივ, არის ან მუდმივი ან ეპიზოდური. სპონტანური ტკივილებიდან ყველაზე უფრო ხშირია (47-50%) წვის შეგრძნება. [8] რაც შეეხება გამოწვეულ ტიპს, მგრძნობელობის გასინჯვით განვითარებული ტკივილი შემთხვევათა 60%-შია აღწერილი, მაშინ როდესაც ტემპერატურული სტიმული, ტკივილს იწვევდა 78%-ში. [11] არანოციცეპტიურ მიზეზთა შორის, ყველაზე უფრო ხშირად,ტკივილის მიზეზი მოძრაობა იყო (70%). საინტერესოა აღინიშნოს, რომ მოძრაობა ამცირებდა ტკივილის ინტენსივობას პაციენტთა 19%-ში. [12] 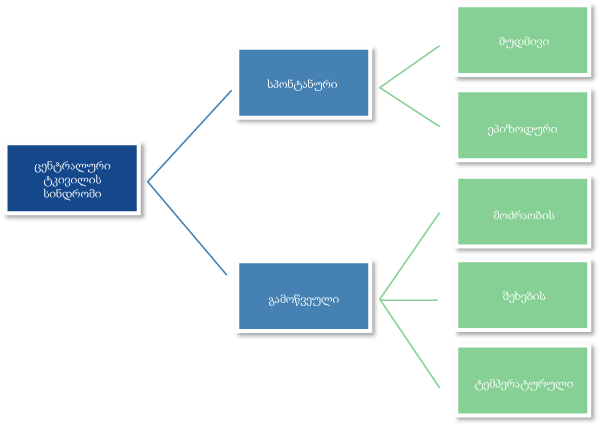 Kilt H და თანაავტორებმა შეიმუშავეს CPSP-ის დიაგნოსტიკური კრიტერიუმი, რომლის მოთხოვნებია: [13] სხვა ტიპის ტკივილის სინდრომის გამოირიცხვა ტკივილის მკაფიოდ გამოხატული ნეიროანატომიური ლოკალიზაცია ინსულტის ანამნეზი მგრძნობელობის მოშლის მკაფიო ნეირონატომიური ლოკალიზაცია ნევროლოგიური გასინჯვით ნეიროგამოსახვითი მეთოდებით (CT, MRI) სისხლძარღვოვანი პროცესით გამოწვეული პათოლოგიის დასაბუთება.
პრეპარატების ამ კლასს მიეკუთვნება ზოგიერთი ანტიკონვულსანტი და ანტიარითმიული საშუალება. თანაავტორებთან ერთად ჩატარებულ რანდომიზებულ გამოკვლევაში Leijoon-მა ერთმანეთს CPSP-ის დროს კარბამაზეპინის, ამიტრიპტილინის და პლაცებოს ეფექტურობა შეადარა. [14] კარბამაზეპინი პლაცებოზე ეფექტური იყო (36% და 7%), მაგრამ ეს სხვაობა სტატისტიკურად სარწმუნო არ აღმოჩნდა. რაც შეეხება ამიტრიპტილინს, მის ეფექტურობას – მოგვიანებით, ამინერგულ საშუალებათა ჯგუფში გავარჩევთ. ანტიარითმიულ საშუალებათა შორის, ინტრავენური ლიდოკაინი ეფექტური იყო 62.5%-ში, მაშინ როდესაც პლაცებოს ეფექტი აღიწერა 37.5%-ში, მაგრამ არც ეს სხვაობა იყო სტატისტიკურად სარწმუნო. [15] სხვა გამოკვლევის მიხედვით მექსილენტინი პერორალური ფორმით ეფექტური გახლდათ, მაგრამ სერიოზული გვერდითი მოველენების გამო, ხანგრძლივ მკურნალობას შეუძლებელს ხდიდა.[16]
ზემოთ აღნიშნულ რანდომიზებულ გამოკვლევაში ამიტრიპტილინი (ტცა), პლაცებოსთან შედარებით, სტატისტიკურად სარწმუნოდ უფრო ეფექტური იყო (67% და 7%) CPSP-ის მკურნალობაში. [14] არარანდომიზებულ ღია გამოკვლევაში, ფლუვოქსამინით (სუმსი) მკურნალობა ტკივილის ინტენსივობას ამცირებდა 22%-ით. [17]
ინტრავენური კეტამინი (NMDA-ანტაგონისტი) ეფექტური იყო შემთხვევათა 48%-ში, მაგრამ ეს ეფექტი მხოლოდ ერთ საათს გრძელდებოდა. [18] ლამოტრიჯინი, რომელიც ასევე NMDA-ანტაგონისტია, ტკივილის ვიზუალურ-ანალოგურ სკალას საშუალოდ 2 ერთეულით ამცირებდა, მაგრამ გამოწვეულ ტკივილს ვერ ცვლიდა.[19]
Yamamoto-ს გამოკვლევაში თიოპენტალი (GABAA-აგონისტი) ამცირებდა ტკივილის ინტენსივობას სტატისტიკურად სარწმუნო 56%-ით.[20] პროპოფოლი, ასევე GABAA-აგონისტი, ამსუბუქებდა ტკივილის ინტენსივობას ავადმყოფთა 70%-ში.[21]
მიუხედავად იმისა, რომ გაბაპენტინი და პრეგებალინი სტრუქტურულად GABA-ს ანალოგებია, მათი მოქმედების მექანიზმი დაკავშირებულია კალციუმის N-ტიპის არხის ბლოკირებასთან. Vrankin-ის და მისი კოლეგების რანდომიზებულ, პლაცებოსთან შედარებულ კვლევაში პრეგაბალინი იწვევდა ვიზუალურ-ანალოგური სკალით ტკივილის შემცირებას 2.5 ერთეულით, მაშინ როდესაც პლაცებო-ჯგუფში ცვლილება არ ფიქსირდებოდა.[22] ტკივილის ამსახველი ქულები ასევე გაუმჯობესდა SF-36 ინსტრუმენტის სკალაზე, მაგრამ ტკივილთან დაკავშირებული დაინვალიდება არ შეცვლილა რაც შეეხება გაბაპენტინს, CPSP-ის დროს მისი ეფექტურობა შეუსწავლელია.
Transcutaneous Elictrical Nerve Stimulation - TENS ნერვის კანგავლითი ელექტრული სტიმულაციის მეთოდი შესწავლილია მხოლოდ ერთ არარანდომიზებულ კვლევაში 15 ავადმყოფზე, სადაც მხოლოდ 4 პაციენტს შეუმცირდა ტკივილის ინტენსივობა 42%-ით, მაშინ როდესაც 5-ს გაუუარესდა ტკივილის სინდრომი.[23]
Deep Brain Stimulation - DBS CPSP-ის დროს ამ ნეიროქირურგიული მკურნალობის მეთოდის შესწავლის შედეგები არაეთგვაროვანია. თალამუსის ვენტრო- პოსტერო-ლატერალური ბირთვის სტიმულაცია 15 ავადმყოფიდან 70%-ში ამცირებდა ტკივილის ინტენსივობას 42-54%-ით,[23] მაშინ როდესაც Rasche-ს და მისი თანაავტორების სტატიაში, ავადმყოფთა მხოლოდ 18%-ში (2/11) იყო ტკივილის შემცირება დოკუმენტურად დასაბუთებული.[25] საინტერესოა აღინიშნოს, რომ პერივენტრიკულარულ რუხ ნივთიერებაში ელექტროდის იმპლანტაციით მცირდებოდა ტკივილთან დაკავშირებული დაბალი სიხშირის პოტენციალების აღმოცენება თალამუსში. [26]
CPSP-ის დროს, მკურნალობის მეთოდის ამ ჯგუფიდან შესწავლილია განმეორებითი ტრანსმაგნიტური სტიმულაცია (repetitive Transmagnetic Stimulation - rTMS) და მოტორული ქერქის პირდაპირი სტიმულაცია (Motor Cortex Stimulation - MCS ). MCS გულისხმობს ელექტროდის პირდაპირ იმპლანტაციას მაგარ გარსსზე, პრეცენტრული ხვეულის წინ. ამ მეთოდის გამოყენებით, Tsubokawa-ს და თანაავტორების გამოკვლევაში ტკივილის ინტენსივობა 50%-ზე მეტით შეუმცირდა ავადმყოფთა 67-73%-ს.[27] ანალოგიური შედეგი იქნა აღწერილი Nguyen-ის ჯგუფის ნაშრომში, სადაც პაციენტთა 77%-ს ტკივილი შეუმცირდა 83%-ით.[28] განმეორებითი ტრანსმაგნიტური სტიმულაცია - rTMS ქერქის პირდაპირი სტიმულაციის - MCS არაინვაზიური ალტერნატივაა. ეს მეთოდი დროებით ამცირებს ტკივილის ინტენსივობას და განმეორებითი პროცედურები ახანგრძლივებს მკურნალობის ეფექტს.[29]
მიუხედავად იმისა, რომ CPSP არ წარმოადგენს ინსულტის ხშირ გართულებას, CPSP ცენტრალური ნეიროპათიური ტკივილის ერთ-ერთი ძირითადი მიზეზია. ამ ტიპის ტკივილის მართვა გართულებულია იმის გამო, რომ მკურნალობის თანამედროვე თერაპიულ და ქირურგიულ მეთოდებს ოპტიმალური შედეგები არ აქვს. CPSP-ის მკურნალობის დროს გასათვალისწინებელია მრავალმხრივი (მულტიდისციპლინური) მიდგომა, რომელშიც სხვადასხვა სპეციალისტების (ნევროლოგი, რეაბილიტოლოგი, ტკივილის სპეციალისტი, ფსიქიატრი, ფსიქოლოგი) კოორდინირებული მონაწილეობა იგულისხმება. CPSP-ის ფარმაკოთერაპიაში ამიტრიპტილინი, ლამოტრიჯინი და პრეგაბალინი პირველი რიგის, ანუ არჩევის პრეპარატებს წარმოადგენენ, მაშინ როდესაც სუმსი-ს ჯგუფის ანტიდეპრესიული საშუალებები და ბაკლოფენი მეორე რიგის სამკურნალო საშუალებებია. ქირურგიული მკურნალობის გათვალისწინება შესაძლებელია მაშინ, როდესაც CPSP მედიკამენტურ მკურნალობას არ ექვემდებარება. მიუხედავად ოპტიმისტური წინასწარი შედეგებისა, ქირურგიული მკურნალობის ფართოდ დანერგვა დამატებით რანდომიზებულ კლინიკურ კვლევებს მოითხოვს.
[1] Pearce JM. Wallenberg's syndrome. J Neurol Neurosurg Psychiatry. 2000 May;68(5):570. [2] Cassarini, Pagni. Central Pain. Harvard University Press; 1969 [3] Harvey RL. Central poststroke pain syndrome. Top Stroke Rehabil. 2010 May-Jun;17(3):163-72. [4] Jauch EC, Saver JL, Adams HP Jr, et all. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013 Mar;44(3):870-947. [5] The PRoFESS trial: future impact on secondary stroke prevention – ინსულტის მეორადი პრევენციის კვლევა, რომელშიც ავადმყოფები განაწილდნენ შემთხვევითი შერჩევის მეთოდით კლოპიდოგრელის ან ასპირინი + დიპირიდამოლის ჯგუფებში. [6] NIH (National Institutes of Health – ჯანმრთელობის ნაციონალური ინსტიტუტი) [7] Harvey RL. Central poststroke pain syndrome. Top Stroke Rehabil. 2010 May-Jun;17(3):163-72. [8] Andersen G, Vestergaard K, Ingeman-Nielsen M, Jensen TS. Incidence of central post-stroke pain. Pain. 1995 May;61(2):187-93. [9] Bowsher D. Central pain: clinical and physiological characteristics. J Neurol Neurosurg Psychiatry. 1996 Jul;61(1):62-9. [10] Kumar B, Kalita J, Kumar G, Misra UK. Central poststroke pain: a review of pathophysiology and treatment. Anesth Analg. 2009 May;108(5):1645-57. [11] Vestergaard K, Nielsen J, Andersen G, et all. Sensory abnormalities in consecutive, unselected patients with central post-stroke pain. Pain. 1995 May;61(2):177-86. [12] Harvey RL. Central poststroke pain syndrome. Top Stroke Rehabil. 2010 May-Jun;17(3):163-72. [13] Klit H, Finnerup NB, Jensen TS. Central post-stroke pain: clinical characteristics, pathophysiology, and management. Lancet Neurol. 2009;8:857–868. [14] Leijon G, Boivie J. Central post-stroke pain--a controlled trial of amitriptyline and carbamazepine. Pain. 1989 Jan;36(1):27-36. [15] Edmondson EA, Simpson RK Jr, Stubler DK, Beric A. Systemic lidocaine therapy for poststroke pain. South Med J. 1993 Oct;86(10):1093-6. [16] Attal N, Gaudé V, Brasseur L, Dupuy M, Guirimand F, Parker F, Bouhassira D. Intravenous lidocaine in central pain: a double-blind, placebo-controlled, psychophysical study. Neurology. 2000 Feb 8;54(3):564-74. [17] Shimodozono M, Kawahira K, Kamishita T, Ogata A, Tohgo S, Tanaka N. Reduction of central poststroke pain with the selective serotonin reuptake inhibitor luvoxamine. Int J Neurosci. 2002 Oct;112(10):1173-81. [18] Yamamoto T, Katayama Y, Hirayama T, Tsubokawa T: Pharmacological classiication of central post-stroke pain: comparison with the results of chronic motor cortex stimulation therapy. Pain 72: 5-12, 1997 [19] Vestergaard K, Andersen G, Gottrup H, Kristensen BT, Jensen TS. Lamotrigine for central poststroke pain: A randomized controlled trial. Neurology 2001; 56: 184–190 [20] Yamamoto T, Katayama Y, Hirayama T, Tsubokawa T. Pharmacological classiication of central post-stroke pain: comparison with the results of chronic motor cortex stimulation therapy. Pain. 1997 Aug;72(1-2):5-12. [21] Canavero S, Bonicalzi V. The neurochemistry of central pain: evidence from clinical studies, hypothesis and therapeutic implications. Pain. 1998 Feb;74(2-3):109-14. [22] Vranken JH, Dijkgraaf MG, Kruis MR, van der Vegt MH, Hollmann MW, Heesen M. Pregabalin in patients with central neuropathic pain: a randomized, double-blind, placebo-controlled trial of a lexible-dose regimen. Pain. 2008 May;136(1-2):150-7. [23] Leijon G, Boivie J. Central post-stroke pain--the effect of high and low frequency TENS. Pain. 1989 Aug;38(2):187-91. [24] Owen SL, Green AL, Stein JF, Aziz TZ. Deep brain stimulation for the alleviation of post-stroke neuropathic pain. Pain. 2006 Jan;120(1-2):202-6. [25] Rasche D, Rinaldi PC, Young RF, Tronnier VM. Deep brain stimulation for the treatment of various chronic pain syndromes. Neurosurg Focus. 2006 Dec 15;21(6):E8. [26] Nandi D, Aziz T, Carter H, Stein J. Thalamic ield potentials in chronic central pain treated by periventricular gray stimulation - a series of eight cases. Pain. 2003 Jan;101(1-2):97-107. [27] Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation in patients with thalamic pain. J Neurosurg. 1993 Mar;78(3):393-401. [28] Nguyen JP, Lefaucher JP, Le Guerinel C, Eizenbaum JF, Nakano N, Carpentier A, Brugières P, Pollin B, Rostaing S, Keravel Y. Motor cortex stimulation in the treatment of central and neuropathic pain. Arch Med Res. 2000 May-Jun;31(3):263-5. [29] André-Obadia N, Peyron R, Mertens P, Mauguière F, Laurent B, Garcia-Larrea L. Transcranial magnetic stimulation for pain control. Double-blind study of different frequencies against placebo, and correlation with motor cortex stimulation eficacy. Clin Neurophysiol. 2006 Jul;117(7):1536-44. |
|
|

